お問い合わせCONTACT
ご相談・ご質問などございましたら、お気軽にお問い合わせください。
お問い合わせフォームストーリーズ
STORIES
SERIES EMBARK

眼の中で光を感じる網膜に異常をきたす遺伝性、進行性の病気である網膜色素変性症。夜盲や視野狭窄が徐々に起こり、視力低下や色覚異常へと進行し、最終的には失明する場合もある。日本では失明原因の第2位を占め、世界で約200万人の患者がいるとされる指定難病(希少疾患)である。現状では有効な治療法がないアンメットメディカルニーズに対して、視覚の再生を目指す遺伝子治療薬の開発に挑んでいるのが、慶應義塾大学医学部発のスタートアップ、株式会社レストアビジョンである。
京都大学理学部生物物理学教室で培われた研究の伝統を背景に、慶應義塾大学医学部と名古屋工業大学の共同研究を経て開発した遺伝子治療は、神経細胞を光に反応するように遺伝子操作する光遺伝学(オプトジェネティクス)という技術を応用したものだ。2016年11月の会社設立から8年3カ月を経て、2025年2月に患者を対象とした国内第Ⅰ/Ⅱ相臨床試験(治験)開始にこぎ着けた。世界初となる視覚再生遺伝子治療の実現を目指す同社の起業の経緯や事業展望などを、代表取締役社長CEOの堅田侑作氏と代表取締役COOの宮﨑輝氏に聞いた。
(聞き手:増田克善)
慶應義塾大学医学部を卒業後、眼科の臨床経験を経て大学院で眼科の遺伝子治療の研究に進みました。高校時代から世界の人を救えるような研究に携わりたいという考えがあったことと、当時ヒトゲノムが解読され話題になり遺伝子工学に興味も持ったことが端緒と言えます。そもそも眼科を選んだのも研究と臨床を両立できるのではと考えたことと、iPS細胞による再生医療の最初の領域が眼科であったように、先端医療の応用において眼科が先頭を走っているという背景があったからです。
眼科研究室で始めた新たな分野の研究は、光で神経活動を制御する光遺伝学(オプトジェネティクス)という技術がちょうど花開き出した頃だったため、その技術を応用して視覚再生を試みることでした。それが今、我々がターゲットにしている難病の網膜色素変性症の視覚再生遺伝子治療です。
光遺伝学を応用した視覚再生では、光をキャッチして生体の信号に変換する光センサータンパク質(光受容タンパク質)が重要な役割を果たします。従来の光遺伝学では視覚再生に実用化できるレベルの光感度が出せないことが大きな課題となっており、遺伝子治療に利用できる光センサータンパク質をどのようにエンジニアリングしようかと考えていたとき出会ったのが、名古屋工業大学の研究成果でした。京都大学出身で名古屋工業大学の教授である神取秀樹先生に相談した際に、微生物ロドプシンと動物ロドプシンのキメラタンパク質(キメラロドプシン)が利用できるのではという感触を得たことから神取研究室との共同研究を2015年にスタートさせました。

共同研究の間も実は私自身、起業をまったく考えていませんでした。医師・研究者として、失明がもたらす患者の生活苦や周囲の負担といった社会課題を解決したいという思いだけでしたが、眼科学教室の当時の教授だった坪田一男先生の勧めによって起業することになりました。坪田先生はご自身もベンチャーを立ち上げたところでしたし、現在の慶應義塾大学医学部発ベンチャー協議会につながるベンチャーエコシステムの醸成に取り組んでおり、起業したらどうかと進められたため、まだ大学院生だった2016年11月にレストアビジョンを設立したという経緯です。
2019年3月に博士号を取得したのを機に代表取締役CEOに就任したものの、役職員は私一人で組織づくりは暗中模索状態。様々なVCなどにも折衝しましたが、資金調達の知識がまったくないので取り合ってもらえず、大学医学部関連の先生方からエンジェル税制を活用して出資していただき運営資金にした次第です。
その後、慶應義塾大学医学部発ベンチャー協議会のイベントにたまたま参加していた宮﨑輝に出会い、意気投合して2020年3月にレストアビジョンに入社してもらいました。
学生時代からアカデミアの技術を事業化するような仕事でキャリアを積みたいと考えてきたこともあり、日本政策投資銀行を経ていくつかのベンチャー企業のCOOやCFOを務めてきました。次にチャレンジしたいという考えもあり、慶大医学部のイベントに参加した際に共通の知人から堅田を紹介されたのがきっかけです。同年齢ということもあり馬が合いそうだと感じたことと、堅田一人の会社だったので私が力を発揮できる要素が多分にあると思ったことが参画の大きなポイントでした。もちろん、堅田から技術的な話を聞く中で、そのユニークさや優位性を理解しました。
当時、堅田が求めていた人材は製薬会社の事業経験者。私は対象外だったようですが、2019年末に入社の意志を伝え、押しかけ女房のような形で参画したのが正直なところです。

新興会社を運営していくうえで、会社として成功を収めたいのか、収益を獲得したいのか、ベンチャー経営者としての名声を得たいのか――。いろいろな考えがあると思いますが、最初に2人で決めたことは私たちが開発した薬を患者さんに届けることを最優先にすることを基軸とすること。会社組織として体制構築はあまり話していませんでした。
最初の2年ほどはフルタイムの役職員は私たち2人で、それ以外は副業・兼業でプロジェクトに参画する人たちで開発を進めてきました。現在でこそフルタイムの役職員は10人ですが、同数以上のパートタイム・副業・兼業のメンバーで事業を運営しています。
そもそも日本で遺伝子治療の開発に携わったことのある人は非常に希少。そうした方が、フルタイムで弱小ベンチャーに入ってくれるというのは非常に難しい。専門知識を持った人にとって兼業という形の方が参画しやすいと思ったため、プロジェクトを進めるための最適な形が結果的に現在の形態だったのです。
創薬・製薬開発は本来ゴールを元に逆算で開発進捗を管理できる発想であったり、グローバル展開につなげていく経験値を有している人材が必要だという問題意識がありました。そうした人の知恵を借りようと考えると、結果として副業というワークスタイルに落ち着いたというのが実情です。
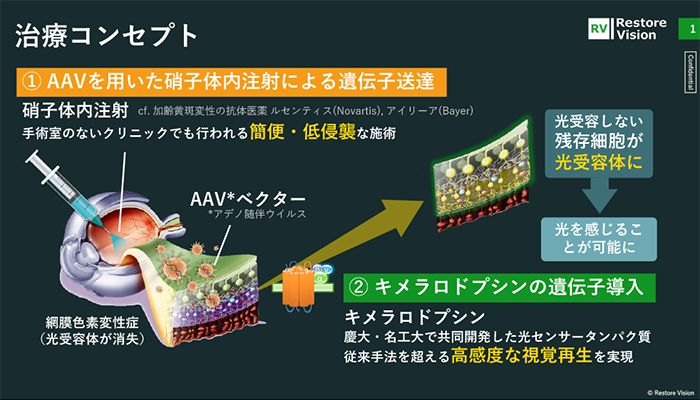
共同研究開発による独自技術であるキメラロドプシンを用いて、夜でも視える高感度な視覚再生遺伝子治療を実現することです。キメラロドプシンというのは、動物型と微生物型ロドプシンの良いとこ取りをした視覚再生に最適化した光センサータンパク質で、「高感度・自立で働き続ける光センサータンパク質」であることが第1の特徴です。
光遺伝学(オプトジェネティクス)を利用した視覚再生を試みる海外ベンチャーがいくつかありますが、従来の光センサータンパク質の多くは微生物型ロドプシンが用いられているため、太陽光のような強い光に対して反応するものの、日常生活での光には反応できないという課題がありました。それを克服したところが技術的な優位性です。
また、遺伝子を細胞に届ける技術には様々な方法がありますが、当社の遺伝子導入では承認薬でも使われているアデノ随伴ウイルスベクター(AAVベクター)と呼ばれる遺伝子の運び屋を利用します。このAAVにキメラロドプシンを発現する遺伝子を載せた治療薬を眼球の硝子体に投与することで、視覚再生を可能にする光センサータンパク質を発現させます。硝子体内注射は糖尿病網膜症や加齢黄斑変性症など様々な眼の病気の治療法として眼科クリニックでも行われている投与方法であり、「簡便・低侵襲」な施術であることが第2の特徴になります。
非臨床段階では、委託製造先で治験薬製造を行うための製剤開発や、薬効薬理試験、安全性試験などの動物試験を行ってきました。それらの結果・資料をまとめ、2024年10月にPMDA(医薬品医療機器総合機構)へ治験届を提出しました。
治験施設である慶應義塾大学病院にて、今まさに重症網膜色素変性症の患者さんを対象とした第I/II相治験が始まったところです(2025年2月13日、同社および慶應義塾大学医学部からプレスリリース発表)。
遺伝子治療薬は希少疾患を対象とすることが多く、グローバル開発を見据えて米国での承認を目指すのが王道ですが、我々は国内を先行しつつ並行して進めています。国内での治験結果を踏まえ、次の資金調達によりグローバル展開せざるを得なかったところですが、幸いにもAMED(国立研究開発法人日本医療研究開発機構)の2023年度「創薬ベンチャーエコシステム強化事業」に採択され、国内と並行してグローバルでの治験準備も進めることができました。
もっとも苦労したのは、治験薬の開発・製造の部分ですね。iPS細胞による再生医療で均質でクオリティの高い細胞を作れるかが非常に難しいのと同様に、ヒトへの投与が可能なレベルの治験薬を製造できるかでした。大手の製薬会社も遺伝子治療薬になかなか手を出せない理由の1つだと思います。そもそも遺伝子治療薬の開発・製造に関わった人は世界的に見ても限られていますし、アカデミアの研究者がベンチャーで働くとなると、そのマネジメントも非常に苦労します。これは現在進行形の課題でもあります。
我々は基本的にファシリティを持たずに研究開発を行っているので、医薬品開発製造に関わるパートナー探しがブレークスルーポイントだったと思います。具体的には、CRO(医薬品開発業務受託機関)やCDMO(医薬品開発・製造業務受託機関)などのパートナーや業界のキーパーソンとどうつながり、協業できるかが重要。とくにものづくりにおいては何度も失敗を経験しましたが、結果として治験薬が製造できたことは幸いでした。また業界のキーパーソンとのつながりについては、堅田の研究活動をベースにした多方面のアクティビティの成果に加え、リードVCの支援もあり、海外の医師、研究者や患者会といったキーパーソン、大手グローバルファーマのBD担当者に関心を持ってもらいつながることができました。それがポイントであり、強みだと思っています。
京都iCAPには出資に留まらず、キーパーソンとのつながりで心強い支援をいただきました。PMDA対応の経験が豊富なコンサルタントを紹介いただいたのもそうですし、長年外資系の製薬会社に在籍していた現経営管理部長を紹介いただいたことも大きな支援でした。

月並みな言い方ですが、卵(アカデミア)の殻を破って、とりあえず会社を立ち上げてみることが大事かなと思います。私自身、背中を押してもらった立場なので強いことは言えませんが・・・。ただ、経営者となるとリスクテイクが大きな課題になるので、覚悟は必要でしょう。
実は私が参画した最初に、1年ほどでの撤退基準を二人で決めていました。具体的には資金調達の目処が立つか、または数千万円規模の研究助成金を取得できるかのどちらもダメだったら止めようというものです。結果的に2つとも実現できたのですが、撤退するという判断基準を持つことが重要だと思います。撤退という判断ができれば、またチャレンジはできますから。
(2025年2月取材。所属、役職名等は取材当時のものです)
レストアビジョンは慶應義塾大学発スタートアップですが、当社が実用化に取り組んでいるロドプシン遺伝子治療の日本における研究の源流は全て京都大学に行き着きます。つまり慶應義塾と京大の融合から誕生したスタートアップと言えます。網膜の異常により失明する患者さんは全世界に数多く存在します。この遺伝子治療が網膜異常による失明を救えるようになれば、社会的に大きな福音を与えることになります。

河野 修己

株式会社レストアビジョン ウェブサイト
ご相談・ご質問などございましたら、お気軽にお問い合わせください。
お問い合わせフォーム